Resumos
INTRODUÇÃO: O arsenal terapêutico contra a leishmaniose tegumentar é muito restrito. Os antimoniais pentavalentes permanecem como as drogas de escolha para seu tratamento há mais de 50 anos. Apesar da sua eficácia, necessita de injeções diárias, apresenta muitos efeitos colaterais e tempo de cura prolongado. OBJETIVO: Realizar uma revisão sistemática da literatura sobre os avanços no tratamento da leishmaniose tegumentar do novo mundo nos últimos dez anos. METODOLOGIA: Realizou-se em junho de 2009 uma busca eletrônica nas bases de dados Pubmed, LILACS e na biblioteca eletrônica Scielo. As palavras de busca em inglês foram: "cutaneous", "leishmaniasis" e "treatment". Foram incluÃdos apenas ensaios clÃnicos randomizados, duplo-cegos, placebo controlados. Utilizou-se a escala de Jadad para avaliar a qualidade dos estudos selecionados. RESULTADOS: Segundo os critérios de inclusão e exclusão, apenas 8 artigos foram selecionados. As drogas avaliadas nos estudos selecionados foram Glucantime®, miltefosine, imunoterapia, imiquimod, rhGM-CSF, pentoxifilina e paramomicina. CONCLUSÃO: Apesar de a leishmaniose tegumentar ser um importante problema de saúde pública, os dados publicados sobre o uso de novas drogas para o tratamento da leishmaniose tegumentar em nosso meio ainda são bastante limitados
Leishmaniose cutânea; Leishmaniose mucocutânea; Terapêutica
INTRODUCTION: The therapeutic arsenal against cutaneous leishmaniasis is very limited. Pentavalent antimonial compounds have been the drugs of choice for treatment of this disease for over 50 years. Despite their effectiveness, these drugs require daily injections, have many side effects and present prolonged healing time. OBJECTIVE: To carry out a systematic literature review on the advances in the treatment of cutaneous leishmaniasis in the new world in the last ten years. METHODS: We conducted an electronic search on the Pubmed and LILACS database as well as on the SciELO electronic library in June 2009. The search words in English were: "cutaneous", "leishmaniasis" and "treatment". We included only randomized, double-blind and placebo controlled trials. We used the Jadad scale to assess the quality of the selected studies. RESULTS: According to the inclusion and exclusion criteria, only eight articles were selected. The drugs evaluated in the selected studies were glucantime®, miltefosine, immunotherapy, imiquimod, rhGM-CSF and pentoxifylline, and paromomycin. CONCLUSION: Although cutaneous leishmaniasis is a major public health issue, the published data on the use of new drugs for the treatment of cutaneous leishmaniasis in Brazil are still quite limited
Leishmaniasis, cutaneous; Leishmaniasis, mucocutaneous; Treatment outcome
REVISÃO
Avanços no tratamento da leishmaniose tegumentar do novo mundo nos últimos dez anos: uma revisão sistemática da literatura* * Trabalho realizado na Escola Bahiana de Medicina e Saúde Pública - Salvador (BA), Brasil.
Olga Laura Sena AlmeidaI; Jussamara Brito SantosII
IAcadêmica de Medicina da Escola Bahiana de Medicina e Saúde Pública Salvador (BA), Brasil
IIDoutora Professora-adjunta de Dermatologia da Escola Bahiana de Medicina e Saúde Pública Salvador (BA), Brasil
Endereço para correspondência Endereço para correspondência: Olga Laura Sena Almeida Rua Emílio Odebrecht, apto 904 torre 2 - 49 - Pituba 41830-300 Salvador - BA Tel.: (71) 8866-5810 E-mail: olga.almeida@ymail.com
RESUMO
INTRODUÇÃO: O arsenal terapêutico contra a leishmaniose tegumentar é muito restrito. Os antimoniais pentavalentes permanecem como as drogas de escolha para seu tratamento há mais de 50 anos. Apesar da sua eficácia, necessita de injeções diárias, apresenta muitos efeitos colaterais e tempo de cura prolongado.
OBJETIVO: Realizar uma revisão sistemática da literatura sobre os avanços no tratamento da leishmaniose tegumentar do novo mundo nos últimos dez anos.
METODOLOGIA: Realizou-se em junho de 2009 uma busca eletrônica nas bases de dados Pubmed, LILACS e na biblioteca eletrônica Scielo. As palavras de busca em inglês foram: "cutaneous", "leishmaniasis" e "treatment". Foram incluídos apenas ensaios clínicos randomizados, duplo-cegos, placebo controlados. Utilizou-se a escala de Jadad para avaliar a qualidade dos estudos selecionados.
RESULTADOS: Segundo os critérios de inclusão e exclusão, apenas 8 artigos foram selecionados. As drogas avaliadas nos estudos selecionados foram Glucantime®, miltefosine, imunoterapia, imiquimod, rhGM-CSF, pentoxifilina e paramomicina.
CONCLUSÃO: Apesar de a leishmaniose tegumentar ser um importante problema de saúde pública, os dados publicados sobre o uso de novas drogas para o tratamento da leishmaniose tegumentar em nosso meio ainda são bastante limitados.
Palavras-chave: Leishmaniose cutânea; Leishmaniose mucocutânea; Terapêutica
INTRODUÇÃO
As leishmanioses são infecções crônicas, não contagiosas, causadas por diversas espécies de protozoários do gênero Leishmania, que são transmitidas de animais infectados para o homem através da picada de um flebotomíneo.1
A incidência mundial de leishmaniose é de dois milhões de casos, sendo 1-1,5 milhão de novos casos de leishmaniose tegumentar (LT).2 A LT é um sério problema de saúde no Brasil, com 388.155 casos notificados nos últimos 15 anos.1
O espectro clínico da LT em humanos inclui a leishmaniose mucosa (LM), leishmaniose cutânea (LC), leishmaniose cutânea disseminada e leishmaniose cutânea difusa.3 As manifestações clínicas da doença são determinadas pelas características do hospedeiro, da espécie de leishmania envolvida e da resposta imune do indivíduo infectado.2
O principal mecanismo de defesa contra a leishmaniose é a resposta imune associada às células T. Na LT, a resposta imune é complexa e não há relação entre a resposta Th1 e a proteção contra a doença,4 visto que os pacientes com LC e LM causadas pela L. braziliensis apresentam uma intensa resposta celular e ainda assim desenvolvem a doença.5 Uma possibilidade para explicar este fato é que uma exacerbada produção de IFN-γ e TNF-α pode ser danosa para o tecido e as mesmas citocinas envolvidas na morte do parasito podem estar associadas à patogênese das LC e LM. 4
A manifestação clínica inicial da doença caracteriza-se por uma pápula eritematosa, única ou múltipla, localizada geralmente na região exposta do tegumento, que evolui para úlcera com bordas elevadas, contornos regulares e fundo com granulações grosseiras, recobertas ou não por exsudato sero-purulento.6 O envolvimento da mucosa nasal, palato, faringe, laringe e cordas vocais pode ocorrer em até 5% dos pacientes.7
O diagnóstico laboratorial pode ser realizado por meio do esfregaço direto da lesão, cultivo in vitro ou in vivo, histopatológico, teste de Montenegro, sorologia e PCR para a detecção do DNA do parasito.8
O arsenal terapêutico contra a leishmaniose ainda é muito restrito.9 Os antimoniais pentavalentes permanecem como as drogas de escolha para o tratamento das leishmanioses há mais de 50 anos. Há comercialmente disponível o antimoniato de N-metilglucamina (Glucantime®) e o estibogluconato de sódio (Pentostam®)10. O Ministério da Saúde do Brasil recomenda 10 a 20 mg/Kg/dia de Glucantime® intravenoso ou intramuscular, por um período de 20 dias, no tratamento das formas cutâneas localizadas e disseminadas. Se não houver cicatrização completa três meses após o término do tratamento, o esquema deverá ser repetido por um período de 30 dias. Persistindo o insucesso terapêutico, deve ser utilizada uma das drogas de segunda escolha.1 Os efeitos colaterais relatados incluem artralgia, mialgia, inapetência, náuseas, vômitos, sensação de plenitude gástrica, pirose, dor abdominal, prurido, febre, fraqueza, cefaleia, tontura, insônia, edema, hepatite com aumento de transaminases e fosfatase alcalina, insuficiência renal aguda, pancreatite e alterações dose-dependentes no eletrocardiograma, tais como alteração da repolarização ventricular com inversão do segmento ST, aumento do intervalo QT, alterações isquêmicas e extrassístoles bigeminadas, polimorfas e polifocais. Arritmias fatais são raras, existindo poucos casos de morte súbita, provavelmente relacionados a arritmias ventriculares.11 A anfotericina B é a droga de segunda escolha quando não se obtém resposta ao tratamento com antimonial ou na impossibilidade de seu uso. A eficácia da pentamidina, a terceira droga de escolha, é bem menos conhecida.9 Vale enfatizar que, mesmo com o tratamento adequado com antimonial, a ocorrência de recidivas e/ou comprometimento de mucosas é frequente, sendo de 2% nos casos tratados e ao redor de 10% nos casos não tratados.1
A realização do presente estudo justifica-se pela importância de conhecer amplamente o que tem sido realizado na tentativa de encontrar novas drogas eficazes, com baixa toxicidade e de custo reduzido, para o tratamento da leishmaniose tegumentar do novo mundo.
OBJETIVO
Realizar uma revisão sistemática da literatura sobre os avanços no tratamento da leishmaniose tegumentar do novo mundo nos últimos dez anos.
METODOLOGIA
Trata-se de uma revisão sistemática da literatura sobre os avanços no tratamento da LT do novo mundo nos últimos dez anos. Realizou-se em junho de 2009 uma busca eletrônica nas bases de dados Pubmed e LILACS e na biblioteca eletrônica Scielo. A busca no Pubmed limitou-se a ensaios clínicos, em inglês, em humanos, publicados nos últimos dez anos. As palavras de busca utilizadas em inglês foram: "cutaneous", "leishmaniasis" e "treatment". Foram excluídos estudos abertos, artigos de revisão e relatos de caso, sendo selecionados apenas os ensaios clínicos randomizados, duplo-cegos e placebo controlados nos quais novos regimes terapêuticos foram utilizados para o tratamento da LT do novo mundo nos últimos dez anos.
Para minimizar as controvérsias associadas à qualidade dos estudos selecionados, a escala de Jadad foi utilizada, considerando quatro e cinco escores de boa qualidade, dois e três escores de média qualidade e um e zero escores de baixa qualidade. Os artigos selecionados deveriam ter pontuação igual ou superior a 4. Esta pontuação compreende: um ponto para estudo randomizado, um ponto se a randomização foi feita adequadamente, um ponto se o estudo é duplo-cego, um ponto se o método duplo-cego foi descrito e é apropriado e um ponto se são descritos os dropouts. 12
RESULTADOS
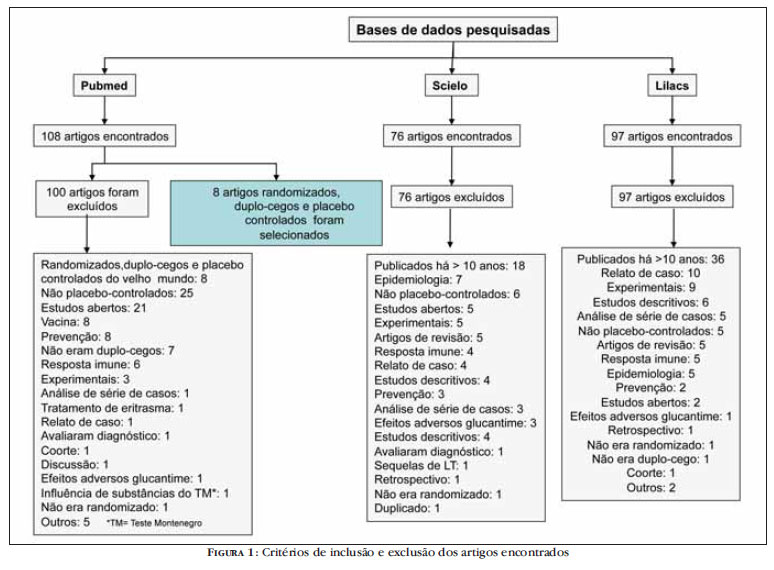
Foram encontrados 281 estudos, dos quais apenas oito foram selecionados. A figura 1 mostra um diagrama de fluxo que evidencia os critérios de inclusão e exclusão dos artigos encontrados.
De acordo com os critérios de Jadad et al.,12 dos estudos selecionados, seis obtiveram nota cinco e dois obtiveram nota quatro. Os resultados da avaliação da qualidade dos estudos selecionados, de acordo com a escala de Jadad, estão descritos no quadro 1.
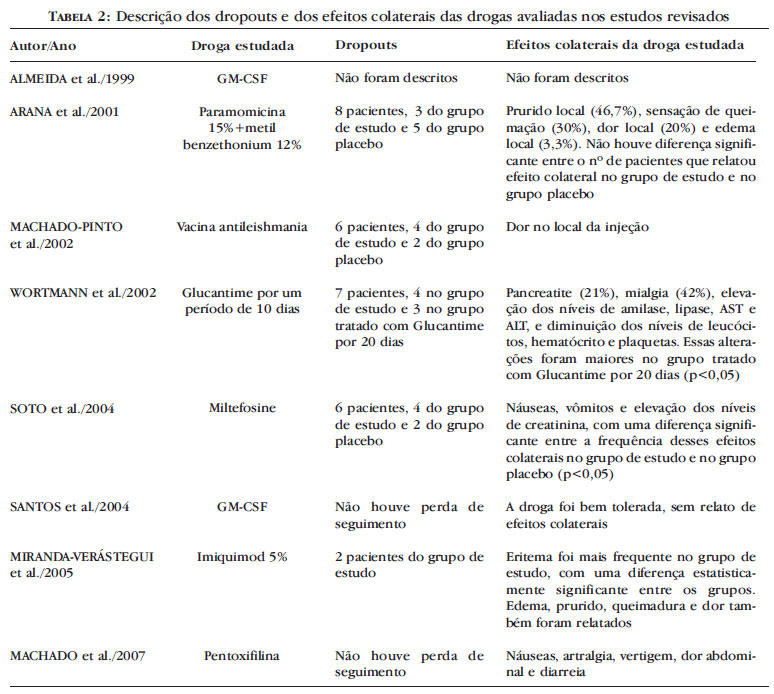
As drogas avaliadas para o tratamento da LT nos estudos selecionados foram Glucantime®, miltefosine, imunoterapia, imiquimod, rhGM-CSF, pentoxifilina e paramomicina. A tabela 1 resume os resultados dos estudos selecionados e a tabela 2 descreve os dropouts e os efeitos colaterais das drogas avaliadas.
DESCRIÇÃO DAS DROGAS E DOS ESTUDOS INCLUÍDOS:
Antimonial pentavalente
Os antimoniais pentavalentes são utilizados no tratamento da LT desde 1945.10 Seu mecanismo de ação permanece desconhecido. In vitro, apresentam pequeno efeito sobre as leishmanias, o que contrasta com os seus resultados clínicos. Questiona-se a possibilidade de estimularem mecanismos imunológicos do indivíduo parasitado.13 No estudo de Wortmann et al. 14 realizado com os militares em atividade dos EUA, em Washington, foram incluídos 36 pacientes infectados por diferentes espécies de leishmania. O estudo avaliou a eficácia do Glucantime® por 10 dias comparado ao Glucantime® por 20 dias para o tratamento da LT. Ao final do tratamento, não houve diferença entre a eficácia do tratamento com dez ou 20 dias de Glucantime® (p = 0,79). Apenas um paciente do grupo tratado com 20 dias de Glucantime® e infectado pela L. braziliensis apresentou recidiva da lesão. Efeitos colaterais ocorreram nos dois grupos. Mialgia ocorreu em oito (42%) pacientes do grupo tratado por dez dias e em treze (68%) pacientes do grupo tratado por 20 dias, persistindo por mais tempo no grupo tratado por 20 dias (p = 0,037). A terapia com 20 dias de Glucantime® levou a um aumento significativo dos níveis de amilase (p = 0,028), lipase (p = 0,003), AST (p = 0,019) e ALT (p = 0,018) em relação à terapia com dez dias de Glucantime.® A diminuição nos níveis de leucócitos (p = 0,012), hematócrito (p = 0,003) e plaquetas (p = 0,006) foi maior no grupo tratado com 20 dias de Glucantime.® Sete pacientes não concluíram o tratamento devido à pancreatite: quatro pacientes do grupo tratado por dez dias e três do grupo tratado por 20 dias.
Miltefosine
O miltefosine é um alquil-fosfolipídio originalmente desenvolvido como agente antineoplásico. Tem efeito tóxico direto sobre as formas promastigotas da leishmania. No entanto, sua ação sobre as formas amastigotas está relacionada ao seu efeito sobre os macrófagos ou sobre a resposta imune dependente da ativação das células T.15 No estudo de Soto et al.,16 foram incluídos 133 pacientes infectados pela L. panamensis, L. braziliensis ou L. mexicana. O estudo avaliou a eficácia do miltefosine comparado ao placebo no tratamento da LC na Colômbia e Guatemala. Nas regiões da Colômbia onde a L. panamensis é comum, a taxa de cura foi de 91% no grupo tratado com miltefosine e de 38% no grupo controle (p < 0,01). Nas regiões da Guatemala onde a L. braziliensis e a L. mexicana são frequentes, a taxa de cura foi de 53% no grupo tratado com miltefosine e de 21% no grupo controle (p = 0,023). A taxa de cura da L. braziliensis foi menor (33%), comparada à taxa de cura da L. mexicana (60%), mas não foi estatisticamente significante. Os efeitos colaterais relatados foram náuseas, vômitos e elevação dos níveis de creatinina, com uma diferença entre a frequência destes efeitos colaterais no grupo de estudo e no grupo controle (p < 0,005).
Imunoterapia
No estudo de Machado-Pinto et al.,9 realizado numa região endêmica do Estado de Minas Gerais, Brasil, foram incluídos 102 pacientes infectados com leishmania para avaliar a eficácia da combinação da vacina, contendo extrato de promastigotas mortas de L. amazonensis, com baixas doses de antimonial pentavalente para o tratamento da LC. Os pacientes foram distribuídos em dois grupos. O primeiro grupo utilizou diariamente 0,5 ml da vacina por via subcutânea com 8,5mg/Kg de Glucantime ® intramuscular por dez dias, seguido por mais dez dias de descanso. O outro grupo utilizou diariamente 0,5 ml de placebo por via subcutânea com 8,5mg/Kg de Glucantime ® intramuscular por dez dias, seguido por mais dez dias de descanso. Os pacientes eram reavaliados a cada 20 dias e, se não houvesse cura, um novo ciclo de tratamento seria iniciado. Após quatro séries de tratamento, 100% dos pacientes tratados com Glucantime ® e vacina antileishmania foram curados e apenas 8,2% dos pacientes tratados com Glucantime ® isolado obtiveram cura (p < 0.0001). O número mediano de séries necessárias para a cura foi três no grupo de estudo e sete no grupo controle (p < 0.005). A terapia com Glucantime ® e vacina anti-leishmania levou a uma cura mais rápida das lesões do que a terapia com Glucantime ® isolado (p < 0.0001). O único efeito colateral relatado foi dor no local da injeção.
Imiquimod
A imidazoquinolina, aprovada para tratamento de verrugas genitais,17 estimula a resposta Th1, aumentando a produção de TNF-α, IFN-γ e IL-12.18 In vitro, apresenta atividade antileishmania por estimular também a produção de óxido nítrico pelo macrófago, diminuindo o número de parasitos.19 No estudo de Miranda-Verástegui et al.,20 realizado nas regiões endêmicas dos Andes peruanos e da selva peruana, foram incluídos 40 pacientes infectados pela L. peruviana ou L. braziliensis. O estudo avaliou a eficácia da combinação de imiquinod 5% tópico e antimonial pentavalente comparada ao uso de antimonial isolado durante 20 dias no tratamento da LC. A proporção de pacientes que alcançou a cura clínica nos meses um, dois e três após o fim do tratamento foi maior no grupo tratado com imiquimod e antimonial (p < 0.02, p < 0.03 e p < 0.02, respectivamente). O efeito colateral mais frequente no grupo tratado com imiquimod foi eritema (p = 0,02). Edema, prurido, queimadura e dor também foram relatados.
rhGM-CSF
O rhGM-CSF é uma glicoproteína que induz ao crescimento de colônias de granulócitos e/ou macrófagos, estimulando suas funções fagocítica e metabólica. Por esse motivo, tem um papel importante na resposta imune contra patógenos intracelulares.21 O papel do rhGM-CSF como adjuvante no tratamento da LC foi avaliado em dois trabalhos. Nos estudos de Almeida et al.22 e Santos et al.23 realizados na área endêmica de Corte de Pedra no Estado da Bahia, Brasil, foram incluídos 20 pacientes infectados pela L. braziliensis. Nos dois estudos, a terapia com o rhGM-CSF levou a uma cura mais rápida das lesões do que a terapia com o antimônio isolado (49 +- 32,8 vs. 110 +- 61,6 dias, p < 0,05; 43 +- 14 vs. 104 +- 79 dias, p = 0,043, respectivamente). No estudo de Almeida et al 22 o rhGM-CSF foi administrado através de injeção intralesional e no estudo de Santos et al. 23 por aplicação tópica. A droga foi bem tolerada, sem relato de efeitos colaterais relevantes.
Pentoxifilina
A pentoxifilina é uma droga de ação vasodilatadora utilizada no tratamento de insuficiência vascular periférica.13 Tem sido utilizada experimentalmente no tratamento de algumas doenças inflamatórias por ter uma ação inibitória sobre o TNF-α.24 No estudo de Machado et al.,25 realizado na área endêmica de Corte de Pedra, Estado da Bahia, Brasil, foram incluídos 23 pacientes com LM infectados pela L. braziliensis. A terapia com pentoxifilina levou a uma cura mais rápida das lesões do que a terapia com o antimônio isolado (83 +- 36 dias vs. 145 +- 99 dias, p = 0,047). A proporção de pacientes que apresentaram doença persistente foi significativamente maior no grupo tratado com antimônio isolado do que no grupo tratado com pentoxifilina (p = 0,047). Os efeitos colaterais relatados foram náuseas (27%), artralgia (9%), vertigem (9%), dor abdominal (9%) e diarreia (9%).
Paramomicina
A paramomicina é um antibiótico que age inibindo a atividade mitocondrial da leishmania.10 No estudo de Arana et al., 26 realizado na Guatemala, foram incluídos 76 pacientes infectados pela L. braziliensis (75%) e L. mexicana (25%). O sulfato de paramomicina a 15% foi utilizado associado ao cloreto de methylbenzethonium a 12%, duas vezes ao dia, durante 20 dias, comparado ao placebo. A resposta clínica após doze meses de seguimento foi de 85,7% no grupo tratado com paramomicina e 39,4% no grupo placebo (p = 0,000025). A falha no tratamento e a reativação da lesão clinicamente curada foram mais frequentes no grupo placebo.
DISCUSSÃO
Este trabalho avaliou os avanços alcançados, nos últimos dez anos, no tratamento da LT por meio de uma revisão sistemática da literatura. Revisões sistemáticas são projetos de pesquisa propriamente ditos, ou seja, trata-se de pesquisa original na qual são empregados procedimentos cuidadosos de busca para encontrar artigos elegíveis, que são selecionados conforme critérios explicitamente definidos e classificados de acordo com sua qualidade. São a melhor forma de iniciar um projeto de pesquisa de dados primários por permitir verificar o que já se sabe e, o mais importante, o que ainda não se sabe. Ajudam a identificar métodos e justificar o tamanho da amostra de novos estudos, mas, por serem estudos observacionais retrospectivos, a presença de vieses é inerente, principalmente os provenientes do modo como a revisão é conduzida e dos estudos incluídos. Elaborar protocolos para eliminar os vieses é um grande desafio. Ainda assim, são um componente essencial para o avanço do conhecimento por cobrirem as lacunas entre pesquisas passadas e futuras e entre pesquisa e assistência clínica.27
A LT distribui-se amplamente no continente americano e é endêmica em alguns países da Ásia e do norte da África. Constitui um problema de saúde pública global, sendo considerada pela Organização Mundial de Saúde como a segunda infecção parasitária mais frequente no mundo. É uma doença em expansão na maioria dos países atingidos, inclusive no Brasil. Tem sido documentada em todas as regiões brasileiras, constituindo, portanto, uma das afecções dermatológicas que merece maior atenção devido à magnitude da doença, ao risco de ocorrência de deformidades, à tendência de crescente avanço para a área urbana, aos danos psicológicos causados no doente e aos reflexos gerados no campo social e econômico.1 A LT, assim como a maioria das doenças infecciosas, é, em grande parte, um problema de paí-ses em desenvolvimento e, por isso, oferece pouco incentivo comercial para as indústrias farmacêuticas desenvolverem drogas baratas e eficazes para seu tratamento.28
Há mais de 50 anos, os antimoniais pentavalentes são o tratamento de escolha para a LT.29 Apesar de serem eficazes, o uso endovenoso, o tempo de cura prolongado, os efeitos colaterais e o custo elevado do tratamento7 levam à necessidade da realização de pesquisas que avaliem regimes terapêuticos diferentes do que é atualmente preconizado para o uso dos antimoniais.30 Wortmann et al.14 sugeriram que o tratamento com Glucantime® por um período de dez dias tem a mesma eficácia e menos efeitos colaterais do que o tratamento com essa mesma droga por um período de 20 dias, apesar de os resultados não terem sido estatisticamente significantes. O estudo tornou-se limitado pelo tamanho reduzido da amostra e pela predominância de pacientes infectados pela L. panamensis. Seria interessante que um estudo, utilizando esse mesmo regime terapêutico e com uma amostra de tamanho adequado, fosse realizado em nosso meio, onde a L. braziliensis é endêmica, para avaliar a susceptibilidade desta espécie de leishmania a este novo regime terapêutico.
O grande desafio das pesquisas que avaliam novas drogas para o tratamento da LT é encontrar um medicamento que seja tão eficaz quanto os antimoniais, porém de fácil administração e de baixa toxicidade. O miltefosine parece ser um tratamento promissor para a LC por ser administrado por via oral e apresentar poucos efeitos colaterais. O tratamento com miltefosine mostrou-se mais eficaz na Colombia, onde a L. panamensis é endêmica. Nesta região, as taxas de cura com antimonial e miltefosine foram similares, em torno de 90%. Por outro lado, o uso de miltefosine na Guatemala, onde a L. braziliensis e a L. mexicana são frequentes, apresentou taxas de cura em torno de 50% comparadas às taxas de cura históricas de 90% com o uso de antimoniais. Soto et al. 31compararam o uso de miltefosine oral com antimonial intramuscular no tratamento da LC causada pela L. braziliensis na Bolívia e encontraram taxas de cura estatisticamente similares entre os grupos. Portanto, torna-se fundamental a realização de estudos randomizados e placebo controlados que avaliem a eficácia do uso de miltefosine nas regiões endêmicas de L. braziliensis no Brasil, uma vez que Soto et a l31 mostraram que o miltefosine parece ser mais efetivo contra a L. braziliensis da Bolívia do que contra a L. braziliensis da Guatemala.
O estudo com imunoterapia associada ao antimonial mostrou resultados favoráveis. A combinação de baixas doses de Glucantime ® e vacina antileishmania levou a uma cura mais rápida das lesões do que a terapia com Glucantime ® isolado no tratamento da LC. Acredita-se que sua associação a baixas doses de antimonial, além de ser eficaz, diminui os efeitos colaterais associados ao uso dessa droga e reduz os custos e a duração do tratamento. A descoberta de uma vacina antileishmania eficaz constitui a principal expectativa para o controle da LT.32 Apesar de muitos estudos estarem sendo realizados neste sentido, a vacina ainda não está disponível na prática clínica e há a necessidade da realização de mais estudos para a confirmação da sua eficácia na prevenção e no tratamento da LT.
A associação do imiquimod ao antimonial também se mostrou efetiva para o tratamento da LC, com diminuição do tempo de cura e melhora da qualidade da cicatriz. O fato de o estudo ter sido realizado com pacientes infectados por espécies diferentes de leishmania tornou difícil identificar se as falhas observadas no tratamento estavam relacionadas à infecção por uma determinada espécie, limitando, desta forma, os resultados. O mecanismo de ação do imiquimod como indutor de uma resposta imune do tipo Th1 pode estar relacionado ao sucesso no tratamento dos pacientes curados com a combinação de imiquimod e antimonial; no entanto, é possível que a indução de uma resposta Th1 não seja o único alvo no tratamento da LC.22
O uso de rhGM-CSF como adjuvante do tratamento com antimonial pentavalente diminuiu significativamente o tempo de cura da LC. Santos33 mostrou que pacientes tratados com rhGM-CSF apresentam um aumento significativo da produção de IL-10, além de maiores níveis de INF-γ e TNF-α em relação ao grupo placebo, e sugeriu a hipótese de que o aumento de IL-10 nesses pacientes possa induzir a uma modulação da resposta imune do tipo Th1, bloqueando parcialmente o efeito de citocinas pró-inflamatórias, com diminuição da inflamação e do dano tecidual. Referiu ainda que a modulação da resposta imune inflamatória pode ser também um importante alvo no tratamento da LC, elevando a possibilidade de redução do tempo de tratamento com antimonial. Além disso, o estudo de Santos34 mostrou que os pacientes tratados com rhGM-CSF têm uma probabilidade menor do uso repetido do antimonial pentavalente, com redução das doses de antimoniais utilizadas e da sua toxicidade. O uso tópico de rhGM-CSF no estudo de Santos et al. 23 reduziu os custos da sua utilização. No entanto, a preparação tópica do rhGM-CSF não está disponível comercialmente e só foi produzida para a realização dessa pesquisa. Os custos elevados dessa medicação tornam difícil sua aplicação na prática clínica, porém, esses trabalhos evidenciam a necessidade da realização de mais estudos com drogas que tenham ação e eficácia semelhante ao rhGM-CSF com um custo reduzido.
Sabe-se que o comprometimento das mucosas pode ocorrer na LT35 e acredita-se que a LM seja desencadeada por uma exacerbação da resposta inflamatória.25 As evidências do papel da resposta imune na patogênese da LM incluem a presença de infiltrado inflamatório apesar da pouca quantidade de parasitos nas amostras de cultura ou biópsia,36 altos níveis de INF-γe TNF-α,4 com aumento da expressão desses mediadores no tecido,37 e uma diminuição da capacidade da IL-10 imunomodular à resposta inflamatória exacerbada.38 A LM causada predominantemente pela L. braziliensis é tratada com antimonial pentavalente e apresenta altas taxas de falha no tratamento e de recidivas. A combinação de pentoxifilina com antimonial diminuiu significativamente o tempo de cura das lesões, sem recidivas documentadas durante os dois anos de seguimento dos pacientes, sugerindo que a ação anti-inflamatória da pentoxifilina é eficaz no tratamento da doença. A pentoxifilina atua inibindo a síntese de TNF-α, IL-2, IL12 e INF-γ, e influenciando a produção de outras citocinas como a IL-4, IL-6 e IL-10.39 A eficácia da pentoxifilina, portanto, parece ser decorrente da sua capacidade de modular extrinsecamente a resposta imune.40 Seu uso associado ao antimonial pentavalente é interessante para o tratamento de pacientes com LM grave e refratária ao tratamento convencional.
O uso da paramomicina mostrou resultados promissores, porém, apesar da vantagem de sua administração tópica, mais estudos metodologicamente adequados precisam ser realizados para comprovar sua eficácia para o tratamento da LT do novo mundo.
A anfotericina B é a droga de segunda escolha quando os antimoniais falham ou quando não podem ser usados. No entanto, é uma droga tóxica e cara, que requer muitas vezes hospitalização para sua administração.9 A alternativa para o tratamento com a anfotericina B convencional é o uso da anfotericina B lipossomal, que apresenta maiores picos plasmáticos e menor toxicidade.7 Apesar da importância do uso da anfotericina B lipossomal no tratamento da LT refratária ao tratamento com antimonial, esta revisão destaca a ausência de estudos randomizados, duplo-cegos e placebo controlados que avaliem o uso dessa droga para o tratamento da LT nos últimos dez anos.
O antimonial pentavalente continua sendo a droga de escolha para o tratamento das leishmanioses cutânea e mucosa. Apesar de sua disponibilidade nas unidades de saúde, sua alta toxicidade e seu uso parenteral são fatores limitantes para o tratamento adequado dos casos de LT. É importante destacar que a maioria desses casos ocorre em áreas de difícil acesso, nas zonas rurais, o que dificulta a aplicação parenteral da droga e o monitoramento de seus efeitos colaterais.32 O tratamento da LT com as drogas disponíveis atualmente representa um obstáculo à condução clínica adequada dos casos de leishmaniose, e esforços devem ser efetivados no sentido de ampliar os ensaios clínicos com as drogas promissoras discutidas nesta revisão e pesquisar o uso de novas drogas alternativas.
A heterogeneidade dos estudos revisados, evidenciada principalmente pelas diferentes espécies de leishmania envolvidas e pela variedade dos tamanhos das amostras, salienta a ausência de um padrão metodológico adequado para a avaliação de novas drogas para o tratamento da LT.
Os ensaios clínicos randomizados e placebo controlados são descritos como o padrão ouro na avaliação de questões terapêuticas em saúde por reduzirem a probabilidade de obtenção de dados tendenciosos na pesquisa.41 Apesar de ser eficiente, este tipo de estudo apresenta limitações práticas. A dificuldade de encontrar um número suficiente de pacientes com a doença de interesse, em um determinado momento e lugar, e o alto custo para conduzir um ensaio clínico cientificamente sólido e de grande porte são suas principais limitações.42 A realização de ensaios clínicos multicêntricos e o aumento dos investimentos do governo em pesquisa clínica podem ser a solução para minimizar essas dificuldades.
Durante o processo de seleção dos artigos para esta revisão, muitos estudos abertos e que não eram placebo controlados foram encontrados e evidenciavam o uso de drogas promissoras para o tratamento da LT. Esses estudos não puderam ser incluídos por não permitirem uma análise comparativa adequada dos seus resultados. No entanto, são estudos importantes que servem de piloto para a realização de ensaios clínicos randomizados, duplo-cegos e placebo controlados, com uma amostra de tamanho adequado. O cálculo correto da amostra de um estudo é de extrema importância na obtenção de resultados mais fidedignos e na redução de custos.41 Nesta revisão, a maioria dos estudos incluídos apresenta uma amostra pequena que restringe a extrapolação dos seus resultados. É importante salientar que, se os estudos obtivessem o mesmo padrão metodológico, mesmo com amostras pequenas, seria possível uma metanálise no futuro, com ampliação dos resultados obtidos.
CONCLUSÃO
Apesar de a LT ser um importante problema de saúde pública no Brasil e nas Américas, os dados publicados sobre o uso de novas drogas para o tratamento da LT em nosso meio ainda são bastante limitados. A realização de mais ensaios clínicos randomizados, duplo-cegos e placebo controlados, com amostras adequadas, é de extrema importância para a avaliação de novos regimes terapêuticos para o tratamento da LT e deve ter como objetivo encontrar drogas eficazes, com baixa toxicidade, de fácil administração e
Recebido em 16.03.2010.
Aprovado pelo Conselho Consultivo e aceito para publicação em 04.09.2010.
Conflito de interesse: Nenhum
Suporte financeiro: Nenhum
- 1. Fundação Nacional de Saúde. Manual de Controle da Leishmaniose Tegumentar Americana. Ministério da Saúde; 2000. p.7-37.
- 2. Sampaio SAP, Rivitti EA. Dermatologia. 3.ed. São Paulo: Artes Médicas; 2008. p.755-64.
- 3. Nassiri-Kashani M, Firooz A, Khamesipour A, Mojtahed F, Nilforoushzadeh M, Hejazi H, et al. A randomized, double-blind, placebo-controlled clinical trial of itraconazole in the treatment of cutaneous leishmaniasis. J Eur Acad Dermatol Venereol. 2005;19:80-3.
- 4. Ribeiro-de-Jesus A, Almeida RP, Lessa H, Bacellar O, Carvalho EM. Cytokine profile and pathology in human leishmaniasis. Braz J Med Biol Res. 1998;31:143-8.
- 5. Carvalho EM, Johnson WO, Barreto E, Marsden PD, Costa JML, Reed S, et al. Cell mediated immunity in American cutaneous and mucosal leishmaniasis. J Immunol. 985;135:4144-8.
- 6. Aguiar Pupo JA. Estudo clínico da leishmaniose tegumentar americana. Rev Hosp Clin. 1946;1:113-64.
- 7. Berman JD. Human leishmaniasis: clinical, diagnostic, and chemotherapeutic developments in the last 10 years. Clin Infect Dis. 1997;24:684-703.
- 8. Singh S, Sivakumar R. Recent advances in the diagnosis of leishmaniasis. J Postgrad Med. 2003;49:55-60.
- 9. Machado-Pinto J, Pinto J, da Costa CA, Genaro O, Marques MJ, Mobabber F, et al. Immunochemotherapy for cutaneous leishmaniasis: a controlled trial using killed Leishmania (Leishmania) amazonensis vaccine plus antimonial. Int J Dermatol. 2002;41:73-8.
- 10. Lima EB, Porto C, Motta JCO, Sampaio RNR. Tratamento da Leishmaniose Tegumentar Americana. An. Bras. Dermatol. 2007;82:111-24.
- 11. Sampaio RNR, Marsden PD, Freitas LCF, Sampaio JHD, Faria EA, Martins Neto E. Morte súbita causada por Glucantime. An Bras Dermatol. 1988;63:35-7.
- 12. Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17:1-12.
- 13. Silva P. Farmacologia. 7 ed. Rio de Janeiro: Guanabara Koogan; 2006. p.687- 1096.
- 14. Wortmann G, Miller RS, Oster C, Jackson J, Aronson N. A randomized, double-blind study of the efficacy of a 10- or 20-day course of sodium stibogluconate for treatment of cutaneous leishmaniasis in United States military personnel. Clin Infect Dis. 2002;35:261-7.
- 15. Kuhlencord A, Maniera T, Eibl H, Unger C. Hexadecylphosphocoline: oral treatment of visceral Leishmaniasis in mice. Antimicrob Agents Chemoter. 1992;36:1630-4.
- 16. Soto J, Arana BA, Toledo J, Rizzo N, Vega JC, Diaz A, et al. Miltefosine for new world cutaneous leishmaniasis. Clin Infect Dis. 2004;38:1266-72.
- 17. Edwards L, Ferenczy A, Eron L, Baker D, Owens ML, Fox TL, et al. Self-administered topical 5% imiquimod cream for external anogenital warts. HPV Study Group. Human PapillomaVirus. Arch Dermatol. 1998;134:25-30.
- 18. Kapsenberg ML. Dendritic-cell control of pathogen-driven T-cell polarization. Nat Rev Immunol. 2003;3:984-93.
- 19. Buates S, Matlashewski G. Treatment of experimental leishmaniasis with the immunomodulators imiquimod and S-28463: efficacy and mode of action. J Infect Dis. 1999;179:1485-94.
- 20. Miranda-Verástegui C, Llanos-Cuentas A, Arévalo I, Ward BJ, Matlashewski G. Randomized, double-blind clinical trial of topical imiquimod 5% with parenteral meglumine antimoniate in the treatment of cutaneous leishmaniasis in Peru. Clin Infect Dis. 2005;40:1395-403.
- 21. Jones TC. The effect of granulocyte-macrophage colony-stimulating factor (rGM-CSF) on macrophage function in microbial disease. Med Oncol. 1996;13:141-4.
- 22. Almeida R, D'Oliveira A Jr, Machado P, Bacellar O, Ko AI, de Jesus AR, et al. Randomized, double-blind study of stibogluconate plus human granulocyte macrophage colony-stimulating factor versus stibogluconate alone in the treatment of cutaneous Leishmaniasis. J Infect Dis. 1999;180:1735-7.
- 23. Santos JB, de Jesus AR, Machado PR, Magalhães A, Salgado K, Carvalho EM, et al. Antimony plus recombinant human granulocyte-macrophage colony-stimulating factor applied topically in low doses enhances healing of cutaneous Leishmaniasis ulcers: a randomized, double-blind, placebo-controlled study. J Infect Dis. 2004;190:1793-6.
- 24. Das BK, Mishra S, Padhi PK, Manish R, Tripathy R, Sahoo PK, et al. Pentoxifylline adjunct improves prognosis of human cerebral malaria in adults. Trop Med Int Health. 2003;8:680-4.
- 25. Machado PR, Lessa H, Lessa M, Guimarães LH, Bang H, Ho JL, et al. Oral pentoxifylline combined with pentavalent antimony: a randomized trial for mucosal leishmaniasis. Clin Infect Dis. 2007;44:788-93.
- 26. Arana BA, Mendoza CE, Rizzo NR, Kroeger A. Randomized, controlled, doubleblind trial of topical treatment of cutaneous leishmaniasis with paromomycin plus ethylbenzethonium chloride ointment in Guatemala. Am J Trop Med Hyg. 2001;65:466-70.
- 27. Haynes RB, Sackett DL, Guyatt GH, Tugwell P. Epidemiologia clínica: como realizar pesquisa clínica na prática. 3 ed. Porto Alegre: Artmed; 2008. p.31-59.
- 28. Iwu MM, Jackson JE, Schuster BG. Medicinal plants in the fight against leishmaniasis. Parasitol Today. 1994;10:65-8.
- 29. Marsden P. Pentavalent antimonials: Old drugs for new diseases. Rev Soc Brasil Med Trop. 1985;18:187-98.
- 30. Arana BA, Navir TR, Arana FE, Berman JD, Rosenkaimer, F. Efficacy of a short course (10 days) of high-dose meglumine antimonate with or without interferon-g in treating cutaneous leishmaniasis in Guatemala. Clin Infect Dis. 1994;18:381-4.
- 31. Soto J, Rea J, Balderrama M, Toledo J, Soto P, Valda L, et al. Efficacy of miltefosine for Bolivian cutaneous leishmaniasis. Am J Trop Med Hyg. 2008;78:210-1.
- 32. Basano AS, Camargo LMA. Leishmaniose tegumentar americana: histórico, epidemiologia e perspectivas de controle. Rev Bras Epidemiol. 2004;7:328-37.
- 33. Santos JB. Efeito do GM-CSF na Leishmaniose Cutânea: Aspectos Clínicos, Terapêuticos e Imunológicos [Dissertação]. Salvador (BA): Universidade Federal da Bahia; 2000.
- 34. Santos JB. Avaliação da Eficácia e Mecanismos Imunológicos do rhGM-CSF como Adjuvante no Tratamento da Leishmaniose Tegumentar [tese]. Salvador (BA): Universidade Federal da Bahia; 2005.
- 35. Jones TC, Johnson WD Jr, Barreto AC, Lago E, Badaro R, Cerf B, et al. Epidemiology of American cutaneous leishmaniasis due to Leishmania braziliensis braziliensis. J Infect Dis. 1987;156:73-83.
- 36. Bittencourt AL, Andrade ZA. Immunopathological aspects of mucocutaneous leishmaniasis. Hospital (Rio J). 1967;71:975-84.
- 37. Pirmez C, Yamamura M, Uyemura K, Paes-Oliveira M, Conceição-Silva F, Modlin RL. Cytokine patterns in the pathogenesis of human leishmaniasis. J Clin Invest. 1993;91:1390-5.
- 38. Bacellar O, Lessa H, Schriefer A, Machado P, Ribeiro de Jesus A, Dutra WO, et al. Up-regulation of Th-1 responses in mucosal leishmaniais patients. Infect Immun. 2002;70:6734-40.
- 39. Strieter RM, Remick DG, Ward PA, Spengler RN, Lynch JP 3rd, Larrick J, et al. Cellular and molecular regulation of tumor necrosis factor-alpha production by pentoxifylline. Biochem Biophys Res Commun. 1988;155:1230-36.
- 40. de Sá Oliveira T, Capp Neto M, Martins BJ, Rodrigues HA, Antonino RM, Magalhães AV. Action of Pentoxifylline on Experimental Cutaneous Leishmaniasis Due to Leishmania (Leishmania) amazonensis. Mem Inst Oswaldo Cruz. 2000;95:477-82.
- 41. Greenberg RS, Daniels SR, Flanders WD, Eley JW, Boring JR. Epidemiologia Clínica. 3 ed. Porto Alegre: Artmed; 2005. p. 30.
- 42. Fletcher RH, Fletcher SW. Epidemiologia Clínica. Elementos Essenciais. 4.ed. Porto Alegre: Artmed; 2006. p.170-71.
Datas de Publicação
-
Publicação nesta coleção
22 Jun 2011 -
Data do Fascículo
Jun 2011
Histórico
-
Aceito
04 Set 2010 -
Recebido
16 Mar 2010