Resumos
OBJETIVOS Mostrar os avanços na pesquisa sobre o papel fisiológico do tecido adiposo branco, ressaltando o seu papel endócrino em processos inflamatórios, no comportamento alimentar, na sensibilização à insulina e na modulação do processo de aterogênese. Abordar o potencial papel do tecido adiposo como fonte de células-tronco para regeneração de tecidos, com especial ênfase para a adipogênese e suas conseqüências para a geração de obesidade. FONTES DE DADOS: Informações importantes constantes da literatura científica foram compiladas de modo a que esta leitura contenha uma síntese esclarecedora dos aspectos mencionados acima. SÍNTESE DOS DADOS:O tecido adiposo possui, além das suas funções clássicas como principal estoque de energia metabólica, suprindo as necessidades energéticas em períodos de carência mediante a lipólise, a capacidade de sintetizar e secretar vários hormônios, as adipocinas. Estas agem em diversos processos, como o controle da ingestão alimentar (leptina) e o controle da sensibilidade à insulina e de processos inflamatórios (TNF-alfa, IL-6, resistina, visfatina, adiponectina). Além disso, como o tecido adiposo contém também células indiferenciadas, tem a habilidade de gerar novos adipócitos, regenerando o próprio tecido (adipogênese), bem como originar outras células (mioblastos, condroblastos, osteoblastos), fato este que tem grande potencial terapêutico em futuro não muito distante. CONCLUSÃO: Amplia-se o leque de possibilidades funcionais do tecido adiposo. A compreensão dessas potencialidades pode fazer deste tecido o grande aliado no combate de moléstias que atualmente vêm assumindo proporções epidêmicas (obesidade, diabetes melito, hipertensão arterial e arteriosclerose), nas quais o tecido adiposo ainda é tido como um grande vilão.
Adipócito; lipogênese; lipólise; adipocinas; adipogênese
OBJECTIVES: To describe the advances in research into the physiological role of white adipose tissue, with emphasis on its endocrinal role in inflammatory processes, feeding behavior, insulin sensitization and modulation of the atherogenetic process. To deal with the potential role of adipose tissue as a source of stem cells for regeneration of tissues, with special emphasis on adipogenesis and its consequences for development of obesity. SOURCES: Important information was compiled from the scientific literature in order that this analysis contains an explanatory synthesis of the aspects mentioned above. SUMMARY OF THE FINDINGS In addition to its classical functions as primary metabolic energy store, meeting energy requirements during periods of deprivation by means of lypolisis, adipose tissue also has the capacity to synthesize and secrete a variety of hormones - the adipokines. These are active in a range of processes, such as control of nutritional intake (leptin) and control of sensitivity to insulin and inflammatory processes (TNF-alpha, IL-6, resistin, visfatin, adiponectin). Furthermore, since adipose tissue also contains undifferentiated cells, it has the ability to generate new adipocytes, regenerating its own tissue (adipogenesis), and also the ability to give rise to other cells (myoblasts, chondroblasts, osteoblasts), which has great therapeutic potential in the not-too-distant future. CONCLUSIONS: The range of functional possibilities of adipose tissue has widened. An understanding of these potentials could make this tissue a great ally in the fight against conditions that are currently assuming epidemic proportions (obesity, diabetes mellitus, arterial hypertension and arteriosclerosis) and in which adipose tissue is still seen as the enemy.
Adipocyte; lipogenesis; lypolisis; adipokines adipogenesis
ARTIGO DE REVISÃO
O tecido adiposo como órgão endócrino: da teoria à prática
Miriam Helena Fonseca-AlanizI; Julie TakadaII; Maria Isabel Cardoso Alonso-ValeIII; Fabio Bessa LimaIV
IFarmacêutica. Doutora, Instituto de Ciências Biomédicas (ICB), Universidade de São Paulo (USP), São Paulo, SP
IINutricionista. Mestra e Doutoranda, Programa de Fisiologia Humana, Instituto de Ciências Biomédicas (ICB), Universidade de São Paulo (USP), São Paulo, SP
IIIFarmacêutica. Doutora e Pós-doutoranda, Laboratório de Fisiologia do Tecido Adiposo, Departamento de Fisiologia e Biofísica, Instituto de Ciências Biomédicas (ICB), Universidade de São Paulo (USP), São Paulo, SP
IVProfessor associado, Departamento de Fisiologia e Biofísica, Instituto de Ciências Biomédicas (ICB), Universidade de São Paulo (USP), São Paulo, SP
Correspondência Correspondência: Fabio B. Lima Depto. Fisiologia e Biofísica, Instituto de Ciências Biomédicas, Universidade de São Paulo Av. Prof. Lineu Prestes, 1524 CEP 05508-900 - São Paulo, SP Tel.: (11) 3091.7248 Email: fabio@icb.usp.br
RESUMO
OBJETIVOS: Mostrar os avanços na pesquisa sobre o papel fisiológico do tecido adiposo branco, ressaltando o seu papel endócrino em processos inflamatórios, no comportamento alimentar, na sensibilização à insulina e na modulação do processo de aterogênese. Abordar o potencial papel do tecido adiposo como fonte de células-tronco para regeneração de tecidos, com especial ênfase para a adipogênese e suas conseqüências para a geração de obesidade.
FONTES DE DADOS: Informações importantes constantes da literatura científica foram compiladas de modo a que esta leitura contenha uma síntese esclarecedora dos aspectos mencionados acima.
SÍNTESE DOS DADOS: O tecido adiposo possui, além das suas funções clássicas como principal estoque de energia metabólica, suprindo as necessidades energéticas em períodos de carência mediante a lipólise, a capacidade de sintetizar e secretar vários hormônios, as adipocinas. Estas agem em diversos processos, como o controle da ingestão alimentar (leptina) e o controle da sensibilidade à insulina e de processos inflamatórios (TNF-a, IL-6, resistina, visfatina, adiponectina). Além disso, como o tecido adiposo contém também células indiferenciadas, tem a habilidade de gerar novos adipócitos, regenerando o próprio tecido (adipogênese), bem como originar outras células (mioblastos, condroblastos, osteoblastos), fato este que tem grande potencial terapêutico em futuro não muito distante.
CONCLUSÃO: Amplia-se o leque de possibilidades funcionais do tecido adiposo. A compreensão dessas potencialidades pode fazer deste tecido o grande aliado no combate de moléstias que atualmente vêm assumindo proporções epidêmicas (obesidade, diabetes melito, hipertensão arterial e arteriosclerose), nas quais o tecido adiposo ainda é tido como um grande vilão.
Palavras-chave: Adipócito, lipogênese,lipólise, adipocinas, adipogênese.
Introdução
Aspectos gerais
As espécies animais precisam garantir a sobrevivência sob condições inóspitas ou desfavoráveis. Vertebrados em geral e mamíferos em particular, por possuírem tecido adiposo (TA), conseguem armazenar o excesso de calorias como lipídeos (triacilgliceróis - TAG). Estes, que são hidrofóbicos, podem ser estocados em grandes quantidades sem usar água como solvente e carregam duas vezes mais energia por unidade de massa que os demais nutrientes.
Sendo o principal reservatório energético, o TA sempre foi conhecido como reservatório energético e como isolante térmico. Estas duas propriedades, por muito tempo, foram aplicadas ao estudo da regulação do metabolismo energético e pouca atenção se deu à análise de outras habilidades suas. As pesquisas sobre o TA o encaravam como tendo um padrão único e uniforme de respostas, sem levar em consideração características como localização ou participação em demandas locais desvinculadas de processos mais globais de controle metabólico. Por isso, os estudos mais antigos, em sua maioria, analisaram respostas metabólicas em amostras de uma determinada região, tomando-a como representativa de toda a massa adiposa. Esses estudos menosprezaram aspectos regionais de ajuste metabólico distorcendo ou ocultando uma importante dimensão funcional sua.
É também verdade que, conforme a origem do TA (por exemplo, se periepididimal ou retroperitoneal), detectavam-se diferenças na sua capacidade lipolítica ou lipogênica. O tecido periepididimal, em roedores em geral, foi largamente utilizado como padrão para avaliar respostas frente às mais diferentes condições, normais ou patológicas. Questionamentos sobre a representatividade deste coxim gorduroso foram surgindo, indicando que uma revisão detalhada sobre o seu papel fisiológico era imperiosa.
Os adipócitos são as únicas células especializadas e perfeitamente adaptadas para armazenar lipídeos sem que isso comprometa a sua integridade funcional. Possuem a maquinaria enzimática necessária para sintetizar ácidos graxos (processo denominado de lipogênese) e estocar TAG em períodos de oferta abundante de energia e para mobilizá-los pela lipólise quando há déficit calórico (lipólise). O sistema nervoso central participa da regulação desses dois processos mediante ações neurais diretas ou indiretas (por exemplo, emitindo comportamentos de busca e ingestão alimentar). Outros sistemas reguladores (digestório e endócrino) participam mediante os nutrientes e hormônios de acordo com as necessidades do momento1.
Através das suas divisões, simpático e parassimpático, o sistema nervoso autônomo atua diretamente sobre o TA. O simpático promove ações catabólicas (lipólise), via estimulação b-adrenérgica que ativa a enzima lipase hormônio-sensível (LHS)2. O parassimpático organiza as ações anabólicas por incrementar a secreção de insulina, aumentando a captação de glicose e de ácidos graxos3.
Nos mamíferos, existem dois tipos de TA: tecido adiposo branco (TAB) e tecido adiposo marrom (TAM). Os adipócitos destes apresentam diferenças importantes. O adipócito branco maduro armazena TAG em uma única e grande gota lipídica que ocupa a porção central da célula, correspondendo a 85-90% da massa celular, e desloca citoplasma, núcleo e demais organelas para a periferia, onde se acomodam dentro de uma fina camada de citosol. Curiosamente, durante seu desenvolvimento, o adipócito jovem contém múltiplas gotículas lipídicas que coalescem para formar uma inclusão lipídica unitária com o amadurecimento. Embora tenham volume variável, os adipócitos brancos maduros são células grandes, centenas a alguns milhares de vezes maiores que hemácias, fibroblastos e células do sistema imune e podem alterar acentuadamente seu tamanho conforme a quantidade de TAG acumulada4.
Além dos adipócitos, o TA contém matriz de tecido conjuntivo (fibras colágenas e reticulares), fibras nervosas, estroma vascular, nódulos linfáticos, células imunes (leucócitos, macrófagos), fibroblastos e pré-adipócitos (células adiposas indiferenciadas)1.
Tecido adiposo marrom
O TAM, especializado na produção de calor (termogênese), está praticamente ausente em humanos adultos, mas é encontrado em fetos e recém-nascidos. Seu adipócito, com 30-40 µm de diâmetro médio, é menor que o branco (diâmetro médio de 60-100 µm). Possui várias gotículas lipídicas citoplasmáticas de diferentes tamanhos, citoplasma relativamente abundante, núcleo esférico e ligeiramente excêntrico e numerosas mitocôndrias que liberam calor pela oxidação de ácidos graxos5. A calorigênese é garantida pela proteína desacopladora-1 (UCP-1 ou termogenina) localizada na membrana mitocondrial interna, que atua como um canal de próton que descarrega o potencial gerado pelo acúmulo de prótons no espaço intermembranoso durante o ciclo de Krebs, desviando-os do complexo F1F0 (ATP sintase), impedindo a síntese de ATP e permitindo que se dissipe em calor5. A alta concentração de citocromo oxidase dessas mitocôndrias contribui para a sua coloração mais escurecida6.
Tecido adiposo branco
Embora a sua participação na termogênese seja desprezível, sua capacidade funcional é bem mais ampla e abrangente. Possui distribuição generalizada pelo organismo, envolvendo, ou mesmo se infiltrando, por quase toda a região subcutânea, por órgãos e vísceras ocas da cavidade abdominal ou do mediastino e por diversos grupamentos musculares para os quais oferece proteção mecânica, amenizando o impacto de choques e permitindo um adequado deslizamento de feixes musculares, uns sobre os outros, sem comprometer a sua integridade funcional. Por ser um excelente isolante térmico e pela distribuição mais abrangente, incluindo derme e tecido subcutâneo, tem papel importante na preservação da temperatura corporal. Pela sua capacidade de armazenar energia (cerca de 200.000-300.000 Kcal em adultos não-obesos) e de fornecê-la quando necessário, assume o status de mais importante sistema tamponante para o balanço energético.
Nos últimos 15 anos, com a descoberta da sua capacidade de secretar hormônios, grande importância foi atribuída ao seu papel endócrino. Estes hormônios, denominados de adipocinas, revolucionaram os conceitos sobre a sua função biológica, consolidando a idéia de ser não apenas um fornecedor e armazenador de energia, mas um órgão dinâmico e central da regulação metabólica.
Dada a diversidade estrutural das adipocinas e a variedade de funções já identificadas, pode-se dizer que elas compreendem desde proteínas relacionadas ao sistema imune - fator de necrose tumoral-a (TNF-a) e interleucina-6 (IL-6) -, a fatores de crescimento - fator transformador de crescimento-b (TGF-b) - e proteínas da via alternativa de complemento (adipsina). Há, ainda, adipocinas envolvidas na regulação da pressão (angiotensinogênio), da coagulação sangüínea (inibidor do ativador de plasminogênio 1, PAI-1), da homeostase glicêmica (adiponectina, resistina, visfatina, leptina) e da angiogênese (fator de crescimento endotelial vascular - VEGF)7, além de várias outras (Tabela 1).
Nesta revisão, faremos um breve relato das adipocinas que mais têm sido estudadas, com especial ênfase para a leptina (LEP), adiponectina (ADP), TNF-a e resistina, embora algum comentário seja reservado a outras.
Leptina
A LEP foi identificada em 1994 como um produto do gene ob descrito em camundongos. Uma cepa de camundongos obesos (ob/ob) apresentava um defeito genético que resultava em não-produção dessa proteína8. Esse animal apresentava, entre outros sinais e sintomas, comportamento e fisiologia de animais em constante jejum, com níveis elevados de corticosterona, incapacidade de se manter aquecido, déficit de crescimento, acentuado hipogonadismo e apetite exacerbado, gerando obesidade, resistência à insulina e diabetes melito.
O seu gene, com três éxons e dois íntrons, localiza-se no cromossomo 7q31.3. Possui, na região promotora, sítios como TATA box e elementos responsivos a proteínas ligadoras ao amplificador CCAAT/enhancer binding protein (C/EBP), elemento responsivo a glicocorticóides (GRE) e elemento responsivo ao AMPc (CRE). A proteína tem 167 aminoácidos (16 KDa). Vários tecidos, além do adiposo, expressam LEP, como placenta, adeno-hipófise, mucosa do fundo gástrico, musculatura esquelética e epitélio mamário, embora, em termos globais, a maior ou menor produção esteja diretamente relacionada à massa de TA, pois os seus níveis circulantes estão mais diretamente relacionados à quantidade de seu RNAm neste tecido. Outros fatores metabólicos e endócrinos contribuem para regular a sua transcrição: a insulina apresenta relação diretamente proporcional com os níveis de LEP. Glicocorticóides, estrógenos, citocinas inflamatórias e quadros de infecção aguda aumentam, ao passo que baixas temperaturas, estimulação adrenérgica, hormônio de crescimento (GH), hormônios tireoidianos, andrógenos, melatonina e fumo parecem diminuir seus níveis. Exibe oscilação circadiana dos seus níveis, pois há aumento das concentrações plasmáticas à noite.
Os receptores de LEP, OB-R, pertencem à família de receptores de citocinas I, que inclui várias interleucinas (IL2 a IL7), GH, prolactina e eritropoetina. Na presença de LEP, seus receptores dimerizam, sofrem alterações conformacionais e ativam proteínas Janus cinase (JAK) e signal transduction and activation of transcription (STAT)7. Neste processo, cada monômero do receptor se fosforila em tirosina pela ação da JAK2, passando a ancorar três proteínas STAT (3, 5 e 6). As STAT são então fosforiladas em tirosina pela JAK, dissociam-se do receptor e formam homo ou heterodímeros que se dirigem no núcleo, onde se ligam a seqüências específicas de DNA, estimulando a expressão de genes específicos. Além desta, outras vias de sinalização já foram demonstradas, tais como JNK (NH2-TERMINAL C-Jun cinase), p38 (p38 MAP cinase), cinase regulada extracelularmente (ERK), fosfolipase C (PLC), prostaglandinas E2/F2 (PGE2/PGF2), entre outras9.
A LEP tem importante papel na regulação do balanço energético, apresentando duas ações: 1) em uma população de neurônios parvo-celulares do núcleo arqueado (ARC) hipotalâmico, estimula a expressão de neuropeptídeos, que induzem inibição da ingestão alimentar (pró-ópio-melanocortina [POMC] e transcrito relacionado à cocaína e anfetamina [CART]) e aumento do gasto energético total, neste caso envolvendo uma população de neurônios similares do núcleo paraventricular (PV) que promovem aumento do tônus simpático; e 2) em outra população de neurônios do ARC, inibe a expressão do neuropeptídeo Y (NPY) e peptídeo agouti (AgRP), envolvidos no aumento da ingestão alimentar e na redução do gasto energético10.
Além desta importante função lipostática (mensurador de depósitos lipídicos do organismo), a LEP modula a reprodução, a angiogênese, a resposta imune, o controle da pressão sangüínea e a osteogênese7.
A LEP é necessária para a maturação do eixo reprodutivo, como se evidenciou pela sua habilidade em restaurar puberdade e fertilidade em ratos ob/ob, acelerar a puberdade em ratos selvagens e facilitar o comportamento reprodutor em roedores. Deficiência ou insensibilidade à LEP estão associadas a hipogonadismo hipotalâmico tanto em humanos como em roedores. Mutações do gene da LEP comprometem seriamente os ciclos menstruais na mulher. Se, por um lado, a LEP é essencial na puberdade e no ciclo reprodutivo, por outro não parece atuar na gestação e na lactação.
No sistema imune, a LEP aumenta a produção de citocinas, a adesão e a fagocitose em macrófagos, além de estimular a proliferação das células T, levando ao aumento da competência imunológica7.
O efeito angiogênico consiste na formação de capilares in vitro em cultura de células endoteliais, prolongando e aumentando a proliferação dessas células.
A LEP promove uma resposta pressora atribuída à ativação do simpático central e uma resposta depressora atribuída à síntese local de NO, indicando que atua de forma dual, produzindo simultaneamente uma ação pressora neurogênica e uma depressora humoral.
Em relação ao metabolismo lipídico, ativa a adenilciclase, aumenta a oxidação lipídica no músculo esquelético e reduz a síntese de TAG no fígado.
Fator de necrose tumoral-a(TNF-a)
O TNF-a é uma citocina imunomodulatória e pró-inflamatória. Foi descrito como fator indutor de caquexia em animais e de inibição da lipogênese em adipócitos. É uma citocina multifuncional, implicada em inflamação, apoptose, citotoxicidade, produção de outras citocinas, como IL-1 e IL-6, e indução de resistência à insulina. Com relação aos adipócitos, age diretamente em processos dependentes de insulina, incluindo a homeostase do metabolismo de carboidratos e de lipídeos11. Inibe lipogênese e estimula lipólise.
Sua expressão e secreção estão aumentadas na obesidade, correlacionando-se positivamente com o índice de massa corporal (IMC), o conteúdo do seu RNAm e o volume de adipócitos. Em ratos obesos, a neutralização do TNF-a melhorou a resposta à insulina, revelando sua relação com resistência insulínica. Em humanos obesos, existe uma forte correlação inversa entre TNF-a e metabolismo de glicose, devido à supressão da sinalização da insulina, reduzindo a fosforilação do substrato 1 do receptor de insulina (IRS-1) e da fosfatidil-inositol-3-cinase (PI3K), com redução da síntese e translocação do transportador de glicose (GLUT-4) para a membrana12.
Esta citocina também está envolvida na indução de aterogênese, participando da migração de monócitos e de sua conversão em macrófagos na parede endotelial por meio da ativação do fator nuclear k-B (NFkB), desencadeando mudanças inflamatórias na parede vascular.
Liga-se a dois tipos de receptores de membrana: TNFR I e II, que medeiam a transdução de sinal desencadeada pelo TNF-a, formando complexos com proteínas adaptadoras citoplasmáticas.
Há mais de 20 anos sabe-se que o TA expressa TNF-a. Apesar da variedade de tipos celulares do TA, todos capazes de produzir citocinas, os adipócitos são os seus principais secretores e expressam ambos os receptores.
TNF-a está associado à resistência à insulina na obesidade. Observou-se uma correlação positiva entre os níveis de seu RNAm no TA subcutâneo e insulinemia em mulheres, e pacientes obesos com resistência à insulina (especialmente mulheres) têm aumento da secreção de TNF-a. Os mecanismos da resistência à insulina induzida por TNF-a incluem: aceleração da lipólise elevando ácidos graxos livres (AGL) na circulação; diminuição da síntese de GLUT4, da expressão do receptor de insulina e do IRS-1.
Adiponectina
A ADP (AdipoQ, apM1, ACRP30), cujo gene, localizado no cromossoma 3q27, foi descrito em 1995, é a proteína mais abundante produzida pelo TA, e suas concentrações variam entre 2 e 10 µg/mL, bem maiores que as dos demais hormônios conhecidos. É uma proteína de 30kDa e, em sua estrutura molecular primária, possui um domínio globular (gADP), um domínio colágeno e uma região variável.
Vários efeitos lhe são atribuídos, como aumento da sensibilidade à insulina, efeitos moduladores de NFkB, inibição do TNF-a. Há uma correlação inversa entre níveis circulantes do hormônio e risco de obesidade, resistência à insulina e doenças cardiovasculares.
O hormônio forma trímeros que circulam em grupamentos (quatro a seis trímeros), constituindo oligotetrâmeros ou oligohexâmeros. Investigações sobre a bioatividade da ADP íntegra (fADP) ou de seu gADP isolado demonstraram que este último encerra praticamente toda a atividade biológica.
Foram identificados os receptores 1 e 2 de ADP. Eles contêm sete domínios transmembrânicos, mas diferem estrutural e funcionalmente de receptores acoplados a proteínas G. O receptor 1 (ADP-R1) é expresso primariamente no músculo e funciona com alta afinidade para gADP e baixa afinidade para fADP. O receptor 2 (ADP-R2) é expresso primariamente no fígado e age como receptor de afinidade intermediária para as formas gADP e fADP. Os efeitos biológicos dependem não somente das concentrações sangüíneas, mas também da especificidade tecidual. A ADP não exibe grandes flutuações na circulação, sugerindo que a liberação ocorre não de modo agudo, mas regulada por mudanças metabólicas de mais longo prazo13. Observam-se também diferenças entre homens e mulheres, sendo mais elevadas nestas, caracterizando um dimorfismo sexual.
Foi bem demonstrada uma correlação negativa entre o grau de obesidade e níveis circulantes de ADP, bem como um aumento na sua concentração com redução de peso, assim como a associação entre hipoadiponectinemia com resistência à insulina e hiperinsulinemia. O aumento da oxidação de ácidos graxos, da captação e utilização da glicose no TA e no músculo esquelético e a redução da produção hepática de glicose, levando a um melhor controle da glicemia, de AGL e de TAG atestam a melhora na sensibilidade à insulina. Em adipócitos de ratos, in vitro, uma redução de 60% na expressão de ADP resultou em um aumento significativo da resistência à insulina. Tiazolidinedionas (TZD), drogas sensibilizadoras de insulina, induzem aumento da secreção de ADP.
Vários efeitos vasculares pela ADP foram descritos: 1) aumento da vasodilatação endotélio-dependente; 2) aumento da vasodilatação endotélio-independente; 3) efeito antiaterosclerótico; 4) supressão da expressão de receptores conhecidos como scavengers de moléculas de adesão vascular; 5) redução da expressão de TNF-a e diminuição dos efeitos desta adipocina sobre a resposta inflamatória do endotélio; 6) abrandamento do efeito de fatores de crescimento sobre a musculatura lisa vascular; 7) inibição dos efeitos de lipoproteínas de densidade baixa oxidadas (oxLDL) sobre o endotélio, com supressão da proliferação celular, da geração de superóxidos e da ativação de proteínas-quinases ativadas por mitógenos (MAP); 8) aumento da produção de NO; 9) estimulação da angiogênese; 10) redução do espessamento da íntima e da musculatura lisa que se segue à injúria da parede de artérias; e 11) inibição de migração e proliferação de células endoteliais.
Adiponectina e aterosclerose
A proteína C reativa de alta sensibilidade (hs-CRP), marcador de risco para doença aterosclerótica coronariana, é expressa pelo TA. Foi descrita uma correlação negativa entre ADP e CRP em humanos com aterosclerose. Essa associação negativa dá suporte à hipótese da ADP como hormônio antagonizador do desenvolvimento de aterosclerose e inflamação vascular.
A adesão dos monócitos ao endotélio vascular e a conseqüente transformação em células espumosas (foam cells) é considerada crucial para o desenvolvimento de doenças vasculares. A ADP inibe a adesão dos monócitos ao endotélio, reduz a diferenciação mielóide, a produção de citocinas pelos macrófagos e a fagocitose. Também inibe a produção e ação de TNF-a e suprime a transformação dos macrófagos em foam cells, isto é, o elo entre inflamação vascular e aterosclerose. Tem sido registrada uma relação entre a capacidade de inibição de fatores de crescimento na musculatura lisa vascular e a redução da migração de macrófagos pela ADP. Portanto, ela tem efeitos celulares antiateroscleróticos diretos.
Sinalização intracelular pela adiponectina
Em fígado, músculo esquelético e TA, a ADP ativa AMP cinase (AMPK). Esta enzima é ativada por múltiplas condições, que levam ao acúmulo de AMP gerado a partir de ATP. A AMPK tem sido implicada na ação da metformina no fígado e TZD na sensibilização à insulina, sugerindo um efeito mediador dos medicamentos antidiabéticos citados e reforçando efeitos da ADP. A AMPK parece também mediar a sinalização em células endoteliais. A ativação da AMPK no endotélio aumenta a oxidação e síntese de ATP. Como AMPK ativa eNOS, este sistema enzimático parece ser um importante elo entre ADP e geração de NO.
Resistina
Foi descrita em 200114, quando se demonstrou uma relação entre resistina e resistência à insulina induzida pela obesidade (daí o nome do hormônio). A resistina tem 12,5 KDa e pertence a uma família de proteínas, genericamente denominadas de resistin-like molecules (RELM), caracterizadas pela presença consistente de um segmento rico em cisteína (11 cisteínas) na extremidade C-terminal. Os principais representantes desta família são: 1) RELM-a (também conhecida como FIZZ1 ou found-in-inflammatory-zone), descoberta em exsudato broncoalveolar desencadeado por processo alérgico; 2) RELM-b (FIZZ2), que se expressa de forma abundante, especialmente em tumores do cólon, sendo relacionada com o processo de tumorigênese; 3) a resistina (FIZZ3) descrita no TA. Devido ao seu segmento rico em cisteína, resistina e RELM-b se dimerizam, formando homo ou heterodímeros.
A sua secreção é aparentemente estimulada pela insulina, mas dados experimentais são inconsistentes. Processos inflamatórios, glicocorticóides e lipopolissacarídeos (LPS) e C/EBP-a aumentam, ao passo que TNF-a e estimulação b-adrenérgica e receptor gama ativado por proliferadores de peroxissomas (PPARy) inibem a sua expressão.
Muitos estudos corroboram a hipótese da associação entre resistina e resistência à insulina: em ensaios em camundongos obesos, nos quais se neutralizou a resistina mediante a utilização de anticorpos, houve melhora na tolerância à glicose e na sensibilidade à insulina; injeções intraperitoneais de resistina provocaram intolerância à glicose e hiperinsulinemia em camundongos normais; em adipócitos 3T3-L1, o uso de soro anti-resistina melhorou de captação de glicose estimulada pela insulina, ao passo que resistina antagonizou esta resposta.
Por outro lado, os estudos com camundongos ob/ob e db/db revelaram que, apesar da hiper-resistinemia desses animais, o tratamento com TZD, que induziu maior aumento da resistinemia, melhorou o quadro de resistência.
Quadros associados com resistência à insulina, como lactação, exposição ao frio e caquexia por câncer, não mostraram aumento da expressão de resistina. Em contrapartida, a remoção da gordura visceral em ratos obesos atenuou ou impediu o desenvolvimento de resistência. A gordura visceral mostrou-se o local de maior expressão da resistina, 15 vezes mais intensa que a gordura subcutânea. Tratamentos com prolactina ou testosterona levaram a aumento de resistência à insulina e aumento da expressão de resistina, bem como a situações patológicas, como hipertireoidismo, ou fisiológicas, como gestação a meio termo, puberdade ou emprego de hormônios esteróides, que evoluíram com aumento da expressão de resistina.
Em seres humanos, o gene da resistina localiza-se no cromossomo 19, e sua expressão, determinada em estudos populacionais, não se correlacionou muito fortemente com obesidade, exceto em um estudo realizado na China.
Estudos em TA humano mostraram que a resistina é mais expressa em pré-adipócitos do que em adipócitos maduros, nos quais é negligível. Entretanto, não há uma clara relação entre obesidade e resistina, embora mesmo nesta questão haja intensa controvérsia, indicando que mais estudos são necessários para aclarar o papel fisiológico da resistina15.
Assim como o TNF-a e a IL-6, a resistina é uma proteína com propriedades pró-inflamatórias secretada por monócitos e adipócitos. Apesar de expressa e secretada em indivíduos magros, seus níveis estão comumente mais elevados na obesidade.
Algumas palavras sobre outras adipocinas
Vários outros produtos de secreção do adipócitos merecem menção (vide Tabela 1). Por exemplo, a proteína estimulante de acilação (ASP), que tem importante efeito na lipogênese, por aumentar a translocação de GLUT-4, a produção de glicerol-3-fosfato e a atividade da diacil-glicerol aciltransferase (DGAT), enzima catalisadora da síntese de TAG. Ao mesmo tempo, inibe a lipólise por meio da inibição da LHS.
Outra adipocina com efeito pró-inflamatório e ação no metabolismo de carboidratos e lipídeos é a IL-6. A sua infusão em doses próximas à fisiológica em humanos saudáveis promove a lipólise, independente da modulação de catecolaminas, glucagon e insulina. Esse efeito se dá a partir da inibição da lipase de lipoproteínas (LLP) e do aumento na liberação de AGL e glicerol. A IL-6 é secretada por macrófagos e adipócitos, e sua expressão pode ser estimulada pelas catecolaminas via receptores adrenérgicos b2 e b 3 do TAB, quando em concentrações elevadas.
PAI-1 promove a formação de trombos e ruptura de placas aterogênicas instáveis e, através da inibição da produção de plasmina, é capaz de alterar o balanço entre fibrinólise e fibrinogênese, contribuindo para a remodelação da arquitetura vascular e processo aterosclerótico. Uma forte correlação, encontrada em indivíduos obesos, entre elevados níveis de PAI-1 e outras condições relacionadas à síndrome metabólica (hiperglicemia, hiperinsulinemia e hipertrigliceridemia de jejum e altas concentrações de LDL-colesterol) vem sendo demonstrada por vários estudos16,17.
A associação entre adiposidade e sistema renina-angiotensina tem sido sugerida em alguns modelos patogênicos. O TAB é capaz de secretar angiotensinogênio e renina e sintetizar receptores AT1 e AT2 de angiotensina II e enzima conversora de angiotensina (ECA), proteínas que participam da diferenciação de adipócitos e da lipogênese, indicando o seu envolvimento com o processo de acúmulo de gordura corporal. Além disso, o forte papel aterogênico da angiotensina II, estimulando diretamente a produção de molécula de adesão-1 (ICAM-1) e fator estimulador de colônia de macrófagos (GM-CSF) na parede endotelial, que aumentam a geração de NO e radicais livres, a atividade plaquetária e a expressão de PAI-1, indica um intenso elo entre obesidade, hipertensão e doenças cardiovasculares. Entretanto, o sistema renina-angiotensina adipocitário não parece ser regulado de forma similar ao renal, uma vez que alterações no teor de NaCl na dieta não modificaram a expressão gênica de seus constituintes.
Recentemente, outras adipocinas foram descobertas: 1) visfatina, adipocina predominante no TA visceral, parece desempenhar um papel importante na regulação da homeostase glicêmica ao se ligar ao receptor de insulina, "mimetizando" a sua sinalização intracelular; 2) apelina, cuja função parece estar relacionada à regulação da ingestão alimentar.
Frente à grande diversidade de proteínas secretadas pelo TAB, assim como de seus efeitos, que atingem desde os próprios adipócitos até outros tecidos do organismo, constata-se cada vez mais que o TAB tem uma ligação direta com patologias associadas à obesidade, em especial a resistência à insulina e a síndrome metabólica.
O TAB distribui-se em diversos depósitos no organismo, anatomicamente classificados como tecido adiposo subcutâneo (TAS) e tecido adiposo visceral (TAV). O TAS é principalmente representado pelos depósitos abaixo da pele nas regiões abdominal, glútea e femoral. O TAV refere-se ao tecido depositado próximo ou mesmo no interior das vísceras da cavidade abdominal, sendo bem exemplificado pelas gorduras mesentérica, omental e retroperitoneal. Há um dimorfismo sexual na distribuição regional do TAB, com as mulheres usualmente tendo maior grau de adiposidade do que os homens e apresentando maior razão TAS/TAV18.
Além das diferenças quanto à localização anatômica, também a funcionalidade e o metabolismo do TAV e do TAS variam de região para região, apresentando uma certa especificidade e, possivelmente, especialização. Nos adipócitos viscerais, o efeito lipolítico das catecolaminas é mais intenso e o efeito antilipolítico da insulina é mais fraco, o que acarreta maior mobilização de AGL pela lipólise a partir dos depósitos gordurosos intra-abdominais do que a partir dos depósitos subcutâneos glúteo-femorais19. A acentuada resposta às catecolaminas no TAV pode estar relacionada à maior quantidade de receptores b 1 e b 2 adrenérgicos na superfície celular e à sua expressão gênica aumentada nos adipócitos abdominais e omentais, em relação aos subcutâneos.
A produção e a secreção de proteínas são atividades metabólicas do TAB que também estão sujeitas a variações regionais. Assim, enquanto a proteína ASP é predominantemente expressa no TAS, a ADP, o angiotensinogênio, a IL-6, o PAI-1 e a proteína de transferência de ésteres de colesterol (CETP) são fatores principalmente secretados pelos adipócitos viscerais. Outro exemplo dessas diferenças refere-se à atividade da enzima 11 b-hidroxi-esteróide desidrogenase tipo 1 (11bHSD1), responsável por gerar cortisol ativo a partir de cortisona, que está aumentada nos adipócitos viscerais quando comparada aos subcutâneos20,21.
Em um estudo no qual se determinaram os níveis de RNAm da LEP em adipócitos isolados de indivíduos obesos, relatou-se maior quantidade de RNAm nos adipócitos subcutâneos do que nos omentais. A secreção e a expressão gênica de LEP foram avaliadas no TAS e no TAV de mulheres obesas e não-obesas, e os resultados demonstraram que a taxa de secreção e os níveis de seu RNAm foram aproximadamente duas a três vezes maiores no depósito subcutâneo do que no omental nos dois grupos de mulheres.
Metabolismo dos adipócitos
Em razão da destacada atuação do TAB, aliada à importância que adquiriu nos últimos tempos, passou a ser considerado um órgão central do controle metabólico. Reforça essa impressão a imensa lista de hormônios que agem sobre este tecido, seja sobre o metabolismo, seja sobre a produção hormonal e a adipogênese (Tabela 2).
Suas principais ações metabólicas podem ser divididas em: lipogênicas (biossíntese, incorporação e armazenamento de TAG) e lipolíticas (liberação de AGL e glicerol).
Para a biossíntese de TAG, o adipócito necessita de glicerol-3-fosfato (glicerol-3-P) e de AGL esterificado com coenzima A (acilCoA). O primeiro provém da via glicolítica, e o segundo da biossíntese a partir de acetilCoA ou da sua captação das lipoproteínas (quilomícrons e VLDL).
Para produzir glicerol-3-P, necessita-se de glicose, o que envolve proteínas transportadoras específicas, os GLUT (GLUT1 e GLUT4), processo controlado pela insulina. Assim, a insulina secretada no período prandial estimula a translocação de GLUT4 para a membrana celular, aumentando o transporte de glicose. Além disso, o ritmo de metabolização da hexose é acelerado pela insulina, gerando mais glicerol-3-P.
Parte dos metabólitos da via glicolítica se direciona à formação de piruvato, que, no interior da mitocôndria, é transformado em acetilCoA pela piruvato desidrogenase (PDH). Este se acopla a oxalacetato pela citrato sintase (CS), gerando citrato. Parte do citrato retorna ao citoplasma, onde sofre a ação da ATP-citrato liase (ATP-CL), reconstituindo acetilCoA. Este, sob a ação da acetilCoA carboxilase (ACC), transforma-se em malonilCoA. Este último entra para a síntese de ácidos graxos, catalisada pela ácido graxo sintase (FAS), e culmina na formação de acilC (Figura 1).
Adipogênese
A diferenciação do TA, denominada de adipogênese, tem sido extensivamente estudada in vitro, com o intuito de desvendar a base molecular e celular do desenvolvimento do tecido e o seu comprometimento em estados fisiológicos e patológicos, de modo a permitir a formulação de estratégias terapêuticas e preventivas do excesso de TA (obesidade) e de sua escassez (lipodistrofias e lipoatrofias).
A adipogênese inicia-se antes do nascimento. A cronologia do aparecimento do TA depende da espécie e do depósito adiposo sob consideração.
Após o nascimento, ocorre rápida expansão do TA, como resultado do aumento do tamanho e do número celular. O potencial de gerar novos adipócitos persiste mesmo na fase adulta. Fatores dietéticos influenciam este processo, pois ratos alimentados com dieta rica em carboidratos ou lipídeos exibem hiperplasia de adipócitos. A diferenciação do pré-adipócito em adipócito é um processo altamente controlado. Fatores de transcrição adipogênicos, incluindo o PPARy, a proteína 1c ligadora do elemento regulado por esteróis (SREBP-1c) e as C/EBP, desempenham papel-chave na complexa cascata transcricional da adipogênese. Sinais hormonais e nutricionais afetam a diferenciação do adipócito positiva ou negativamente, e componentes envolvidos na interação célula-célula ou na matriz celular também são importantes na regulação do processo23.
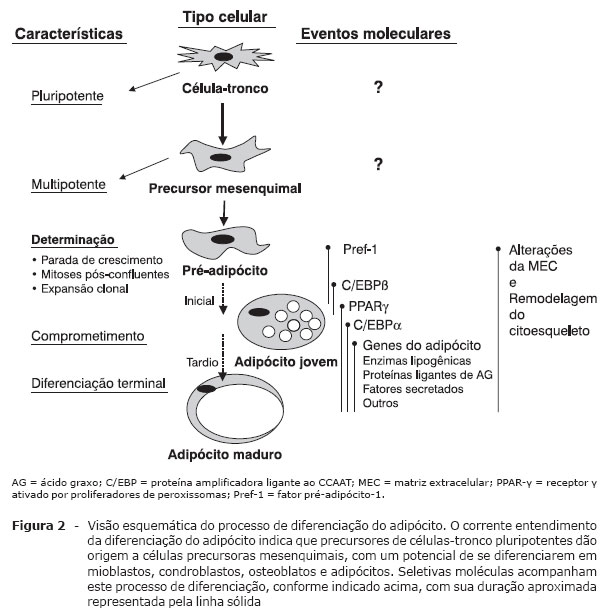
Os pré-adipócitos são linhagens celulares derivadas de células-tronco embrionárias multipotentes de origem mesodérmica e com capacidade de se diferenciar em adipócitos, condrócitos, osteoblastos e miócitos (Figura 2).
Adaptado de Gregoire et al.23.
A proteína SREBP é um fator de transcrição clonado originalmente do TA de rato com as seguintes características: é do tipo hélice-alça-hélice básico (bHLH), contém um zipper de leucina com importante papel na adipogênese, na sensibilidade insulínica e na homeostase dos ácidos graxos24. A família SREBP tem dois membros: SREBP-1 e SREBP-2. Existem duas isoformas do SREBP-1 (SREBP-1a e SREBP-1c), derivadas de splicing alternativo do primeiro éxon dentro do mesmo transcrito primário. O fator de determinação e diferenciação dependente do adipócito (ADD1) é homólogo à isoforma SREBP-1c de humanos25. O SREBP-1c/ADD1 é predominantemente expresso em fígado, glândula adrenal, TA e músculo esquelético, enquanto o SREBP-1a, no baço. O SREBP-2 regula a biossíntese de colesterol. In vitro, o ADD1/SREBP-1c aumenta a atividade transcricional do PPARy, elevando a proporção de células em processo de diferenciação.
O PPARy pertence a uma superfamília de receptores nucleares. É altamente expresso no TA e estimula a transcrição de muitos genes específicos do adipócito, assim como os passos iniciais críticos da adipogênese26. Existem duas isoformas de PPARy (PPARy-1 e -2) geradas por promotores distintos e mecanismos alternativos de splicing. O PPARy-1 é altamente expresso no TA e em menor proporção em várias outras células (macrófagos, pneumócitos, epitélio do cólon, etc.). O PPARy-2 é exclusivo do TA. Possui a região N-terminal com 30 aminoácidos a mais que o PPARy-1. O PPARy é ativado por compostos denominados TZD, usados como agentes antidiabéticos.
Os C/EBP pertencem à família b-zip (domínio básico de ligação do DNA), que contém um zipper de leucina necessário para a dimerização. As isoformas do C/EBP (a, b e Î' ) são altamente expressas no adipócito e induzidas durante a adipogênese. O C/EBPa tem papel importante na diferenciação de pré-adipócitos em adipócitos. O C/EBPb também induz adipogênese, possivelmente por estimular a expressão do PPARy, cujo gene contém sítios para C/EBP na região promotora. Foi demonstrado que o PPARy atua sinergisticamente com C/EBPa para promover a adipogênese27 ou para induzir a diferenciação de fibroblastos em adipócitos26. C/EBPa e PPARy se ligam à região promotora e ativam genes específicos do TAB, tais como a proteína aP2 ligadora de ácidos graxos e a fosfoenolpiruvato carboxiquinase (PEPCK).
Sabe-se que o envelhecimento é um processo caracterizado pelo declínio funcional de muitos processos, incluindo adipogênese28. Estudos moleculares mostraram que a expressão de C/EBPa diminui substancialmente em pré-adipócitos em processo de diferenciação com o avançar da idade. Esta queda em função da idade atingiu vários grupamentos adiposos (periepididimal, inguinal e perirenal).
Além da diferenciação, mudanças na expressão dos fatores de transcrição influenciaram também a função metabólica do adipócito. Com efeito, uma redução do tamanho celular e uma menor expressão de C/EBP prejudicaram a tolerância à glicose por comprometer a expressão do GLUT4, entre outros mecanismos.
Considerações finais
Evidentemente, os avanços dos últimos anos na pesquisa sobre a biologia do TA modificaram a compreensão do seu real papel dentro do organismo, tornando imperiosa uma profunda revisão conceitual sobre o TA. É também claro que obesidade associada ou não a diabetes melito, hipertensão arterial sistêmica ou síndrome metabólica é fator de alto risco para lesões ateroscleróticas potencialmente letais. Contudo, devido à gama de habilidades funcionais e ao imenso arsenal de mecanismos que o TA dispõe para corrigir desvios metabólicos, é importante que se considere a possibilidade de utilizar essas habilidades na promoção da saúde e na prevenção ou combate à doença. O melhor entendimento das potencialidades do TA, sem dúvida, fará dele um grande aliado no combate não só às moléstias supramencionadas, mas a muitas outras, podendo vir a ser o grande agente interno na promoção da saúde.
- 1. Ahima RS, Flier JS. Adipose tissue as an endocrine organ. Trends Endocrinol Metab. 2000;11:327-332.
- 2. Pénicaud L, Cousin B, Leloup C, Lorsignol A, Casteilla L. The autonomic nervous system, adipose tissue plasticity, and energy balance. Nutrition. 2000;16:903-8.
- 3. Kreier F, Fliers E, Voshol PJ, Eden CG, Havekes LM, Kalsbeek A, et al. Selective parasympathetic innervation of subcutaneous and intra-abdominal fat - functional implications. J Clin Invest. 2002:110:1243-50.
- 4. Pond C. Ecology of storage and allocation of resources: animals. In: Encyclopedia of Life Sciences. Chichester, UK: John Wiley & Sons; 2001. p. 1-5.
- 5. Cannon B, Nedergaard J. Brown adipose tissue: function and physiological significance. Physiol Rev. 2004;84:277-359.
- 6. Curi R, Pompéia C, Miyasaka CK, Procópio J. Entendendo a gordura: os ácidos graxos. São Paulo: Manole; 2002.
- 7. Fruhbeck G, Gómez-Ambrosi J, Muruzabal J, Burrel MA. The adipocyte: a model for integration of endocrine and metabolic signalling in energy metabolism regulation. Am J Physiol Endocrinol Metabol. 2001;280:E827-47.
- 8. Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature. 1994;372:425-32.
- 9. Frübeck G. Intracellular signalling pathways activated by leptin. Biochem J. 2006;393:7-20.
- 10. Schwartz MW, Woods SC, Porter D Jr, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature. 2000;404:661-71.
- 11. Sethi JK, Hotamisligil GS. The role of TNF alpha in adipocyte metabolism. Semin Cell Dev Biol. 1999;10:19-29.
- 12. Arner P. Differences in lipolysis between human subcutaneous and omental adipose tissues. Ann Med. 1995;27:435-8.
- 13. Park KG, Park KS, Kim MJ, Kim HS, Suh YS, Ahn JD, et al. Relationship between serum adiponectin and leptin concentrations and body fat distribution. Diabetes Res Clin Pract. 2004;63:135-42.
- 14. Steppan CM, Bailey ST, Bhat S, Brown EJ, Banerje RR, Wright CM, al. The hormone resistin links obesity to diabetes. Nature. 2001;409:307-12.
- 15. McTernan PG, McTernan CL, Chetty R, Jenner K, Fisher FM, Lauer MN, et al. Increased resistin gene and protein expression in human abdominal adipose tissue. J Clin Endocrinol Metab. 2002;87:2407-10.
- 16. Lyon CJ, Law RE, Hsueh W. Minireview: adiposity, inflammation, and atherogenesis. Endocrinology. 2003;144:2195-200.
- 17. Wajchenberg B L. Subcutaneous and visceral adipose tissue: their relation to the metabolic syndrome. Endocr Rev. 2000;21:697-738.
- 18. Rosenbaum M, Pietrobelli A, Vasseli JR, Heymsfield SB, Leibel RL. Sexual dimorphism in circulating leptin concentration is not accounted for by differences in adipose tissue distribution. Int J Obes Relat Metab Disord. 2001;25:1365-71.
- 19. Arner P, Hellström L, Wahrenberg H, Brönnegard M. Beta-adrenoceptor expression in human fat cells from different regions. J Clin Invest. 1990;86:1595-600.
- 20. Wajchenberg BL, Gianella-Neto D, da Silva ME, Santos RF. Depot-specific hormonal characteristics of subcutaneous and visceral adipose tissue and their relation to the metabolic syndrome. Horm Metab Res. 2002;34:616-21.
- 21. Lafontan M, Berlan M. Do regional differences in adipocyte biology provide new pathophysiological insights? Trends Pharmacol Sci. 2003;24:276-83.
- 22. Unger RH, Zhou YT, Orci L. Regulation of fatty acid homeostasis in cells: novel role of leptin. Proc Natl Acad Sci USA. 1999;96:2327-32.
- 23. Gregoire FM, Smas CM, Sul HS. Understanding adipocyte differentiation. Physiol Rev. 1998;78:783-809.
- 24. Osborne TF. Sterol regulatory element- binding proteins (SREBPS): key regulations of nutritional homeostasis and insulin action. J Biol Chem. 2000;275:32379-82.
- 25. Tontonoz P, Kim JB, Graves RA, Spiegelman BM. ADD1: a novel helix-loop-helix transcription factor associated with adipocyte determination and differentiation. Mol Cell Biol. 1993;13:4753-59.
- 26. Tontonoz P, Hu E, Spiegelman BM. Regulation of adipocyte gene expression and differentiation by peroxisome proliferator activated receptor gamma. Curr Opin Genet Dev. 1995;5:571-6.
- 27. Tontonoz P, Hu E, Spiegelman BM. Stimulation of adipogenesis in fibroblasts by PPAR gamma 2, a lipid-activated transcription factor. Cell. 1994;79:1147-56.
- 28. Kirkland JL, Hollenberg CH, Kindler S, Gillon WS. Effects of age and anatomic site on preadipocyte number in rat fat depots. J Gerontol. 1994;49:B31-35.
Datas de Publicação
-
Publicação nesta coleção
17 Dez 2007 -
Data do Fascículo
Nov 2007